什么是没有医疗用途的产品?
无医疗用途的产品(附录十六 MDR)是指虽然没有制造商预定的医疗用途(例如美学或美容目的),但仍受到与 “经典” 医疗器械(例如彩色隐形眼镜、吸脂设备或皮肤填充剂)相同的监管监督的产品。
这是在哪里监管的?
1。MDR 附件十六 — 列出了尽管缺乏医疗用途但仍属于 MDR 要求的六个特定产品组。
第 2 个 实施条例(欧盟)2022/2346 —为所有附件十六产品组设定通用规范,包括风险管理、安全信息、标签和操作说明等特定产品要求(自2023年6月22日起适用)。
第 3 个 实施条例(欧盟)2022/2347 —规范某些活性附件十六产品的重新分类(重新分类),因为MDR分类规则9和10(活性疗法/诊断)与医疗用途有关(自2022年12月22日起生效)。
第 4 个 MDCG 2023-5 和 MDCG 2023-6 — 指导医疗器械协调小组对附件十六产品进行资格认证和分类。
第 5 个 MPDG(医疗器械实施法)— 德国实施MDR要求,包括附件十六法规。
第 6 个 国家政府指导方针 — 例如德国的 VombFarm,用于附件十六产品的实际用途。
哪些产品(虽然不是医疗用途的产品)会受到满足这些较高的 MDR 安全标准的影响?
附件十六列出了以下具体产品: 无 应该具有药物治疗作用,但仍必须以与医疗器械相同的方式进行监管——因为它们构成相似的风险。
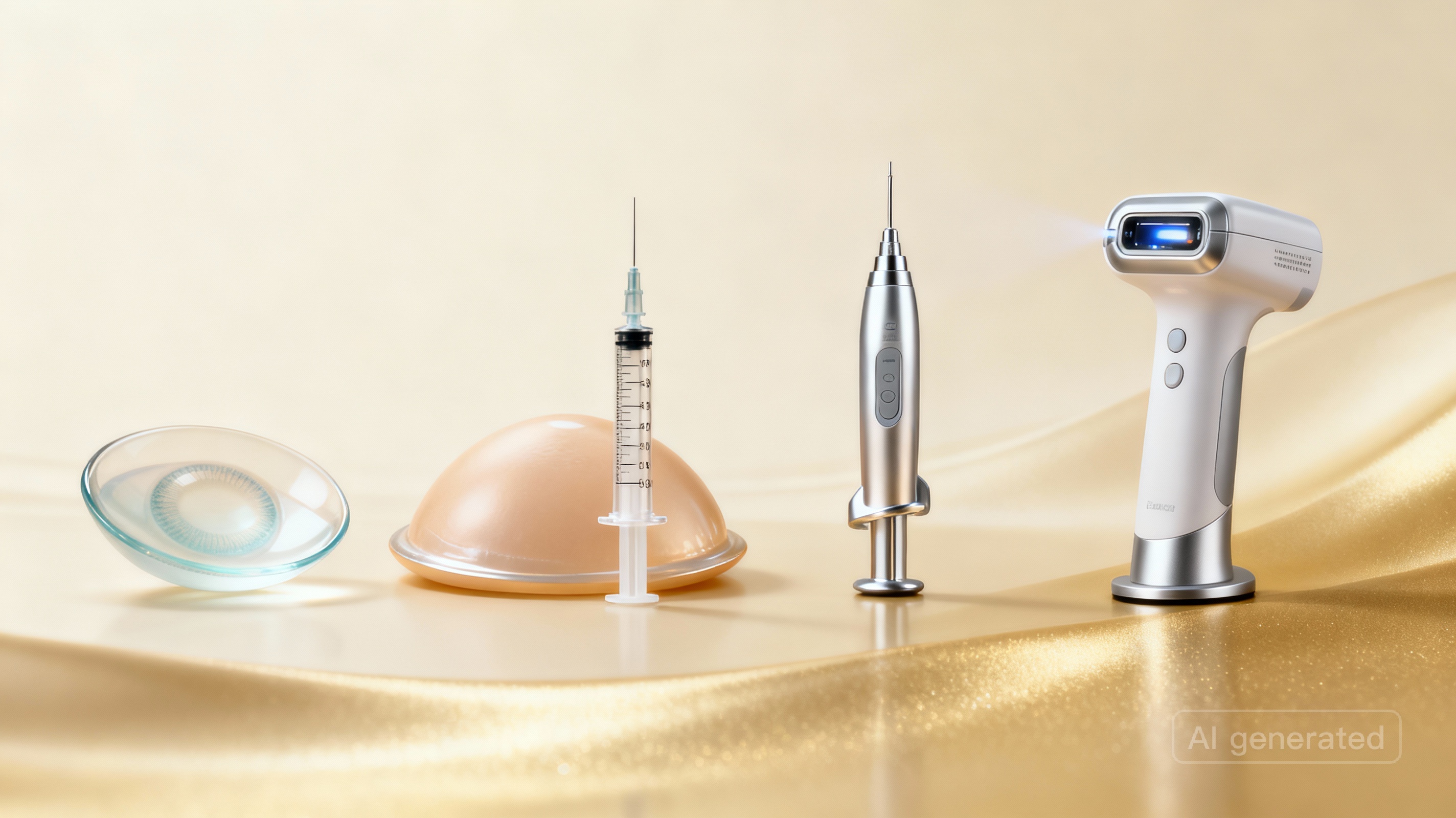
六个产品组:
- 没有视力矫正功能的隐形眼镜 — 彩色或有色隐形眼镜纯粹是为了改变外观,而不是为了改善视力。
- 用于身体改造的固定植入物 — 例如,硅胶乳房植入物或其他永久插入的改变体型的物体(穿孔和纹身是 不 包括在内)。
- 身体填充物(皮肤填充物) — 注射到面部或其他皮肤/粘膜区域以丰满的物质(例如透明质酸填充物、胶原蛋白植入物)。
- 吸脂设备 — 用于机械缩小、去除或分解脂肪组织(吸脂、脂肪融化、脂肪形成)的设备。
- 大功率照明设备 — 发射热辐射、可见光或紫外线辐射的设备(激光、强光照明设备),用于脱毛、去除纹身、紧肤或其他皮肤治疗。
- 脑刺激设备— 通过头骨顶部传导电磁场以改变大脑活动的设备。
从监管角度来看,附件十六的产品有什么特别之处?
与真正的医疗设备一样,制造商必须证明这些产品是安全的。 但是: 你必须 没有医疗补助 证明应该没有。相反,它们必须满足以下要求:
- 风险管理: 系统记录和降低风险
- 一般要求(常用规格): 根据自 2023 年 6 月起生效的第 2022/2346 号实施条例规定的产品特定要求
- 分级: 根据实施条例 2022/2347 划分风险组(通常为 IIa 或 IIb 类)
- 合规评级: 视类别而定,由公告机构或自我申报
- 上市后监测: 上市后的系统监测
- 标签和用户手册: 必须明确标记为 “未经医学鉴定”
这对制造商意味着什么?
对于制造商而言,这意味着他们必须实施附件十六产品的整个 MDR 合规架构——包括质量管理体系、风险分析、临床评估、公告机构的合规性评估(视风险等级而定)和上市后监督——尽管这些产品并未作为 “医疗器械” 正式销售,这会带来重大的监管和经济挑战,尤其是在区分临床证据和安全要求时。
这些产品是否需要临床试验才能确认愈合声明?
不,附件十六的产品不需要临床试验即可确认愈合声明——因为顾名思义,它们不能发表愈合声明。但是,它们需要临床评估。
根据MDR第61(9)条,对于无医疗用途的产品(附件十六),要求具有 临床益处 为了证明,要求只有 安全与性能 来证明产品。这些产品不得宣称任何医疗或治疗功效——任何治疗声明都将受到法规的禁止,并且会自动将该产品重新校准为具有医疗目的的医疗器械,这意味着附件十六法规将不再适用。有趣的是,尽管如此,通常仍需要进行临床测试,除非存在与相应产品等效的 “模拟” 医疗器械,但没有医疗用途。
您是否需要有关医疗器械分类的评估或初步建议,或者您想知道是否需要临床试验或临床试验? 联系我们 请随时联系我们进行初步咨询!
展示您的产品的医疗益处
凭借我们多年的经验和专业知识,我们提供有效的解决方案,以展示您的产品的医疗益处。
从临床前和临床研究的构思到实施,我们为您提供量身定制的服务。
了解 MEDIACC 如何帮助您获得产品退款。
