Und was sind Produkte ohne medizinische Zweckbestimmung?
Produkte ohne medizinische Bestimmung (Anhang XVI MDR) sind Produkte, die zwar keinen von Herstellern beabsichtigten medizinischen Zweck verfolgen (z.B. ästhetische oder kosmetische Ziele), aber aufgrund ihrer funktionalen Ähnlichkeit und vergleichbaren Risikoprofile mit Medizinprodukten trotzdem derselben regulatorischen Überwachung wie „klassische" Medizinprodukte unterliegen – wie beispielsweise farbige Kontaktlinsen, Liposuktionsgeräte oder Dermalfüller.
Wo wird das geregelt?
1. MDR Anhang XVI – listet die sechs spezifischen Produktgruppen auf, die trotz fehlender medizinischer Zweckbestimmung unter MDR-Anforderungen fallen.
2. Durchführungsverordnung (EU) 2022/2346 –legt Common Specifications (gemeinsame Spezifikationen) für alle AnhangXVI-Produktgruppen fest, einschließlich produktspezifischer Anforderungen anRisikomanagement, Sicherheitsinformationen, Kennzeichnung undGebrauchsanweisung (anwendbar seit 22. Juni 2023).
3. Durchführungsverordnung (EU) 2022/2347 –regelt die Reklassifizierung (Neuklassifizierung) bestimmter aktiver AnhangXVI-Produkte, da sich die MDR-Klassifizierungsregeln 9 und 10 (aktivtherapeutisch/diagnostisch) auf medizinische Zweckbestimmung beziehen (in Kraftseit 22. Dezember 2022).
4. MDCG 2023-5 und MDCG 2023-6 – Leitliniender Medical Device Coordination Group zur Qualifizierung und Klassifizierungvon Anhang XVI-Produkten.
5. MPDG (Medizinprodukte-Durchführungsgesetz)– deutsche Umsetzung der MDR-Anforderungen, einschließlich AnhangXVI-Regelungen.
6. Nationale Behördenleitlinien – z.B. vomBfArM in Deutschland zur praktischen Anwendung bei Anhang XVI-Produkten.
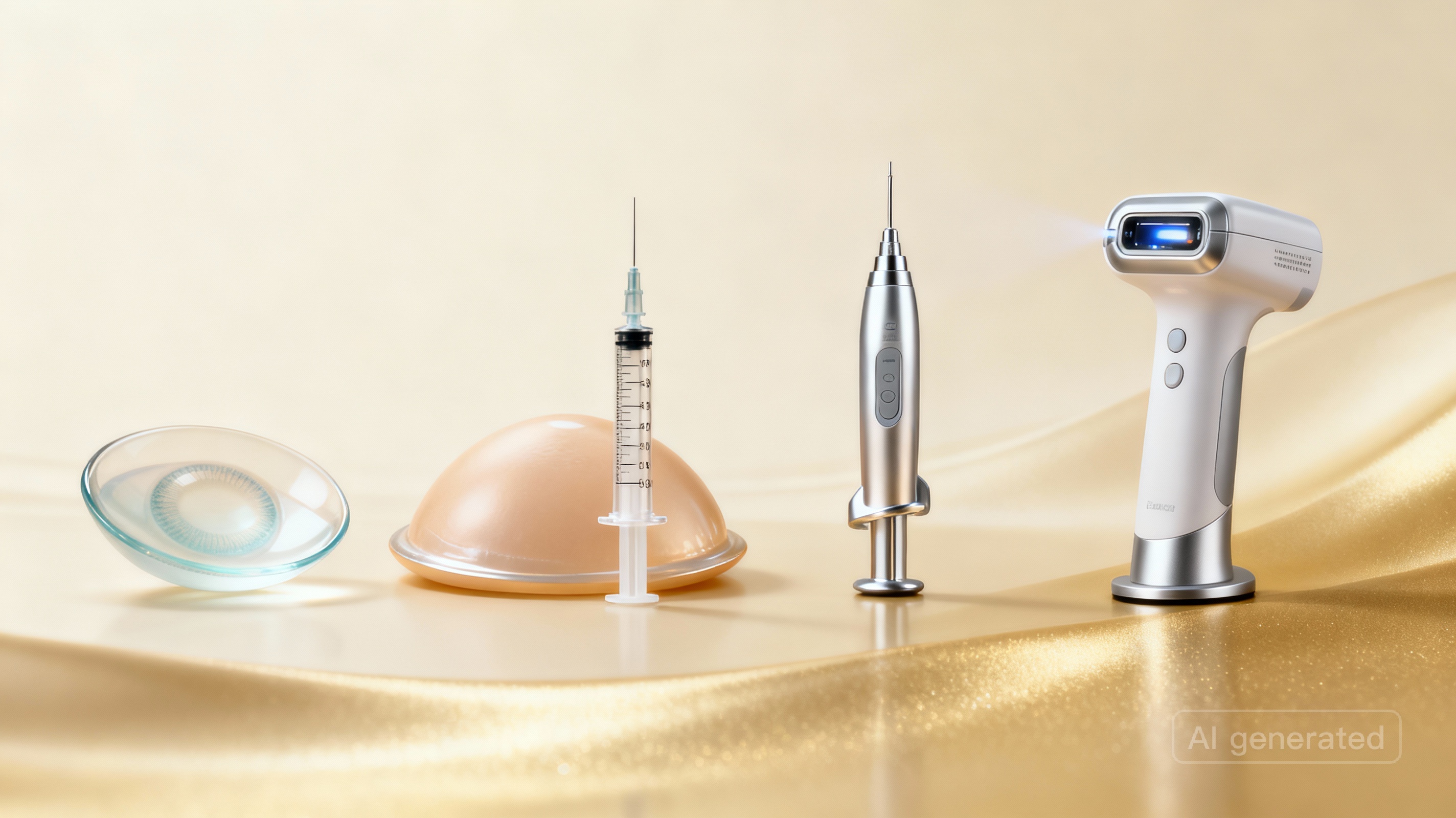
Welche Produkte sind - obwohl sie keine Produkte mit medizinischer Zweckbestimmung sind - davon betroffen, diese hohen Sicherheitsstandards der MDR einzuhalten?
Anhang XVI listet besondere Produkte auf, die keine medizinische Heilwirkung haben sollen, aber trotzdem wie Medizinproduktereguliert werden müssen – weil sie ähnliche Risiken bergen.
Die sechs Produktgruppen:
- Kontaktlinsen ohne Sehkorrektur – farbige oder getönte Kontaktlinsen rein zur optischen Änderung, nicht zur Sehverbesserung.
- Feste Implantate zur Körperveränderung – z.B. Silikonbrustimplantate oder andere dauerhaft eingesetzte Gegenstände, die die Körperform verändern (Piercings und Tätowierungen sind nicht enthalten).
- Körperfüllstoffe (Dermalfüller) – Stoffe, die in Gesicht oder andere Haut-/Schleimhautbereiche eingespritzt werden, um aufzupolstern (z.B. Hyaluronsäure-Filler, Kollagen-Implantate).
- Fettabsauggeräte – Geräte zur mechanischen Verringerung, Entfernung oder Zersetzung von Fettgewebe (Fettabsaugung, Fettaufschmelzung, Fettgestaltung).
- Hochleistungslichtgeräte – Geräte, die Wärmestrahlung, sichtbares Licht oder UV-Strahlung aussenden (Laser, Intensivlicht-Geräte) für Haarentfernung, Tätowierungsentfernung, Hautstraffung oder andere Hautbehandlungen.
- Hirnreizungsgeräte– Geräte, die elektromagnetische Felder durch die Schädeldecke leiten, um Gehirnaktivität zu verändern.
Was macht Anhang XVI-Produkte behördlich besonders?
Die Hersteller müssen – wie bei echten Medizinprodukten –zeigen, dass diese Produkte sicher sind. Aber: Sie müssen keinen medizinischen Nutzen nachweisen, da es keinen geben soll. Stattdessen müssen sie folgende Anforderungen erfüllen:
- Risikoverwaltung: Systematische Erfassung und Verringerung von Gefahren
- Allgemeine Anforderungen (Gemeinsame Spezifikationen): Produktspezifische Anforderungen gemäß Durchführungsverordnung 2022/2346, die seit Juni 2023 gelten
- Einstufung: Unterteilung in Risikogruppen (meist Klasse IIa oder IIb) gemäß Durchführungsverordnung 2022/2347
- Übereinstimmungsbewertung: Je nach Klasse durch Benannte Stellen oder Eigenerklärung
- Überwachung nach Markteinführung: Systematische Beobachtung nach Marktstart
- Kennzeichnung und Gebrauchsanleitung: Muss klar als „ohne medizinische Bestimmung" gekennzeichnet sein
Was bedeutet das für Hersteller?
Für Hersteller bedeutet dies, dass sie für Anhang XVI-Produkte die gesamte MDR-Compliance-Architektur implementieren müssen – einschließlich Qualitätsmanagementsystem, Risikoanalyse, klinische Bewertung, Konformitätsbewertung durch Benannte Stellen (je nach Risikoklasse) und Post-Market Surveillance – obwohl diese Produkte formal nicht als "Medizinprodukt" vermarktet werden, was zu erheblichen regulatorischen und wirtschaftlichen Herausforderungen führt, insbesondere bei der Abgrenzung zur klinischen Evidenz und Sicherheitsanforderungen.
Benötigen diese Produkte eine klinische Studie benötigen, um eine Heilsaussage zu bestätigen?
Nein, Anhang XVI-Produkte benötigen keine klinische Studie, um eine Heilaussage zu bestätigen – weil sie definitionsgemäß keine Heilaussage treffen dürfen. Allerdings benötigen sie eine klinische Bewertung.
Gemäß Artikel 61(9) MDR ersetzt für Produkte ohne medizinische Bestimmung (Anhang XVI) die Anforderung, einen klinischen Nutzen nachzuweisen, durch die Anforderung, lediglich die Sicherheit und Leistung des Produkts zu belegen. Diese Produkte dürfen keinerlei medizinische oder therapeutische Wirksamkeit beanspruchen – jegliche Heilaussage wäre regulatorisch unzulässig und würde das Produkt automatisch zu einem Medizinprodukt mit medizinischer Zweckbestimmung umqualifizieren, womit die Anhang XVI-Regelung nicht mehr anwendbar wäre. Interessant ist, dass dennoch generell eine klinische Prüfung gefordert wird, es sei denn es gäbe ein "analoges" Medizinprodukt, für das die Gleichwertigkeit mit dem entsprechenden Produkt ohne medizinische Zweckbestimmung vorläge.
Sie benötigen eine Einschätzung bzw. zunächst Beratung zur Klassifizierung Ihres Medizinprodukts oder fragen sich, ob Sie eine klinische Studie oder klinische Prüfung benötigen? Kontaktieren Sie uns gerne für ein erstes Beratungsgespräch!
Zeigen Sie den medizinischen Nutzen Ihres Produkts
Mit unserer langjährigen Erfahrung und Expertise bieten wir effektive Lösungen, um den medizinischen Nutzen Ihres Produktes zu zeigen.
Von der Konzeption bis zur Durchführung von präklinischen und klinischen Studien unterstützen wir Sie mit maßgeschneiderten Dienstleistungen.
Erfahren Sie, wie MEDIACC Ihnen zur Erstattungsfähigkeit Ihrer Produkte helfen kann.
